- אודותינו
- מחקר
- סטודנטים והוראה
- סמינרים וארועים
- בעלי תפקידים
- הזמנת חדרים ומיכשור
- English
דף הבית » ד"ר דינה שניידמן, פרופ' מיכל ליניאל וד"ר ניר קליסמן מאפיינים את "הרשת החברתית" של נגיף הקורונה
כל הנגיפים עושים שימוש נרחב ביכולות התא המארח לצורך השלמת מחזור ההדבקה שלהם - החל במפגש הראשוני עם התא המאכסן, ועד לשחרורם של מאות נגיפים חדשים בעלי יכולת הדבקה.
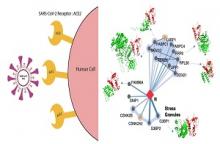
כדי לזהות את עקב אכילס של נגיף הקורונה (SARS-CoV-2), על מנת שיוכל לשמש מטרה לטיפול תרופתי, חיוני להשיג מודלים מבניים מפורטים של כל הקומפלקסים החלבוניים השונים, המהווים את רשת האינטראקציות בין חלבוני הנגיף לחלבוני התא המאכסן.
לאחרונה דווח על ניסוי בקנה מידה גדול של קבוצות מאוניברסיטת סן פרנסיסקו שבדק את רשת האינטראקציות של כל 29 החלבונים הנגיפיים. מאות זוגות של חלבונים (חלבון נגיפי וחלבון אנושי) דווחו כמועמדים העשויים להוות יעד טיפולי אטרקטיבי. האתגר האמיתי הוא לזהות את הזוגות המבטיחים ביותר מבחינה טיפולית, ולסנן את אלה הצפויים להיכשל במאמץ לעיצוב תרופות.
מובן שזיהוי מטרות מבטיחות מחייב אפיון מבני של צמדי החלבונים האנושיים והחלבונים הנגיפיים. אולם אפיון מבני במעבדה של מאות הזוגות של החלבונים המועמדים הינו מעבר ליכולות של הטכנולוגיות הקיימות בלוחות זמנים סבירים. לפיכך, אנו מציעים לגשר על הפער באמצעות שילוב של כלים חישוביים לבניית מודלים מבניים עם ספקטרומטרית מסות, דינמיקה מולקולרית ומחקר המתמקד בשונות הגנטית של הנגיף ושל אוכלוסיות אנושיות.
במסגרת מחקר המתבצע בימים אלה בשיתוף פעולה בין קבוצות המחקר של דינה שניידמן, ניר קליסמן ומיכל ליניאל תוקפים החוקרים את המשימה מכיוונים שונים המשלימים זה את זה.
ראשית, אנו מנצלים מודלים מבניים קיימים כדי לאפיין אינטראקציות בין חלבוני הנגיף והמאכסן. חלבונים נגיפיים מדמים לעיתים קרובות אינטראקציה "תקנית" בין חלבונים תאיים. לפיכך, עושים המודלים שלנו שימוש באינטראקציות עם מבנים ידועים של חלבונים אנושיים כתבניות המאפשרות לחקור מנגנוני חיקוי מולקולריים של הנגיף, היות שבמנגנון החיקוי מציג הנגיף שטח פנים דומה לזה של החלבון האנושי כדי לתפוס את מקומו.
בנוסף, אנו מפעילים שיטות סימולציה של דינמיקה מולקולרית (MD) בכדי לחשוף את המימד הדינמי של האינטרקציות החלבוניות. בתהליך זה אנו בוחנים לא רק את חלבוני הנגיף המקורי, אלא גם את החלבונים המוטאנטיים, שדיווחים עליהם מתקבלים בעקבות איפיון הווריאציות הגנומיות ההולכות ומצטברות עם עליית התפשטות הנגיף ברחבי העולם.
כפי שציינו, הנגיף הגורם למחלת ה- COVID-19, בדומה לנגיפי RNA אחרים, עובר שינויים גנטיים המשקפים את קצב המוטציות הגבוה של נגיפים מסוגו. להשלמת המשימה נאמץ גישה חדשנית, המבוססת על קיבוע של אינטראקציות תוך תאיות בעזרת רכיב כימי פעיל, המאפשר קישור בלתי הפיך בין מולקולות המצויות בתא השלם בטווח מרחקים מולקולריים קצרים (רכיבים כימיים אלה נקראים מצמדים -cross-linkers ). תוצרי תהליך הצימוד מוכנסים למכשיר המכונה ספקטרומטר מסות, המאפשר את זיהוים בעזרת מדידת מסה מדויקת (XL-MS). שיטה זו מאתרת אינטראקציות חלבון-חלבון בדיוק כפי שהן מתרחשות בתא השלם. אנו נשתמש במצמדים החודרים ביעילות לקרומי התא, כדי לחשוף אינטראקציות חדשות (שעשויות לנבוע מהופעת מוטציות חדשות) ולאמת אינטראקציות שהוצעו על סמך בחינת המודלים המבניים. הנתונים המבניים שיופקו בעזרת ריאקציות הצימוד יאפשרו לנו לשפר משמעותית את הדיוק של המודלים שלנו.
כבר עכשיו יש בידינו תוצאות ראשוניות מעודדות. יישמנו את שיטת המידול המבני והפעלנו סימולציות כדי לאפיין את הקישור של חלבון הכתר (spike protein) של SARS-CoV-2 לקולטן האנושי (ACE-2). בדרך זו התברר כי הנגיף הנוכחי יוצר שטח מגע גדול יותר עם הקולטן, בהשוואה לנגיפי קורונה אחרים.
יתר על כן, מצאנו שאזורי המגע עם הקולטן משתנים בעקבות מוטציות הרבה יותר מהר משאר חלקי הנגיף. המשמעות היא שכפי הנראה יהיה קשה יותר לפתח תרופות וחיסונים המבוססים על אינטראקציה זו, שיעמדו במבחן הזמן ושיהיו חסינים בפני השינויים הגנטיים הצפויים. תוצאות אלה פורסמו לאחרונה בעיתון המדעי Viruses